Visando tau, a outra proteína por trás da doença de Alzheimer
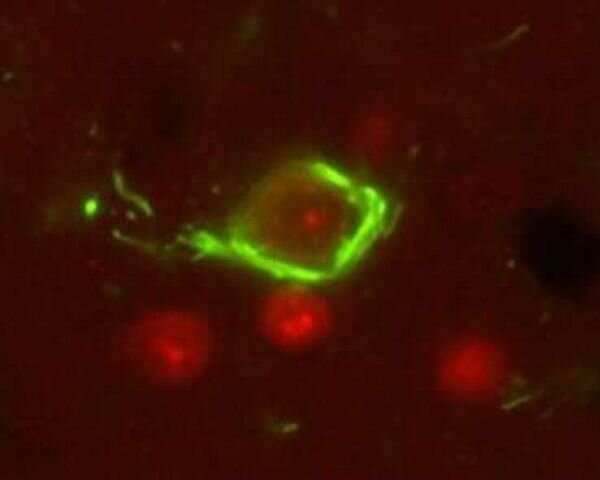
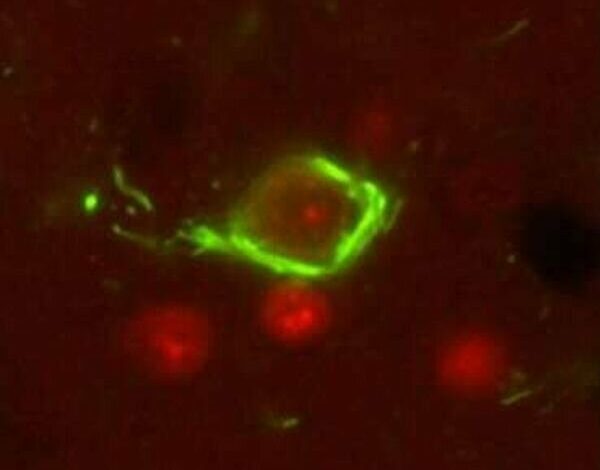
As proteínas tau defeituosas formam emaranhados neurofibrilares insolúveis (verde) que causam a morte dos neurônios. Crédito: Laboratório Kraemer
Em novembro, os pesquisadores relataram que a droga lecanemab retardou a progressão da doença de Alzheimer. O efeito foi modesto, mas gerou grande entusiasmo porque foi a primeira vez que uma droga demonstrou ser capaz de afetar o curso dessa doença implacável e incurável.
A droga, lecanemab, é um anticorpo fabricado que ajuda a limpar um proteína anormal chamado beta-amilóide, que forma aglomerados insolúveis chamados placas amiloides por aí células cerebrais. Acredita-se que o amiloide inicia e mantém a destruição das células cerebrais que leva ao declínio cognitivo e eventual demência que aflige pacientes com Alzheimer.
Mas muitos pesquisadores acreditam que, para qualquer tratamento ter um grande impacto no curso da doença de Alzheimer, eles também terão que atingir uma segunda proteína que até agora não recebeu tanta atenção quanto a beta-amilóide, uma proteína chamada tau.
“As placas amilóides iniciam a cascata da doença, por isso faz sentido tentar eliminá-las, mas é a tau que mata as células”, disse Brian Kraemer, professor de medicina da Divisão de Gerontologia e Medicina Geriátrica da Escola de Medicina da Universidade de Washington. Medicamento.
Kraemer é especialista em doenças neurodegenerativas causadas pela tau, chamadas tauopatias. Estes incluem uma longa lista de doenças neurodegenerativas incuráveis. Em alguns, a tau anormal parece ser a causa primária do distúrbio. Estas são chamadas de tauopatias puras. Eles incluem degeneração lobar frontotemporal, paralisia supranuclear progressivae doença de Pick. Por outro lado, a doença de Alzheimer é chamada de tauopatia mista, porque beta-amilóide desempenha um papel.
Tau, que rima com “uau”, estabiliza estruturas cruciais dentro das células, chamadas microtúbulos. Essas estruturas servem como esqueleto interno de uma célula e atuam como condutos através dos quais a célula transporta material de um lugar para outro.
Na doença de Alzheimer e outras tauopatias, a tau é defeituosa. Ele se desprende dos microtúbulos e forma agregados insolúveis dentro das células chamados emaranhados neurofibrilares. A quebra dos microtúbulos e o acúmulo de emaranhados neurofibrilares interrompem a capacidade de funcionamento da célula cerebral e, eventualmente, levam à morte celular.
“Se tivéssemos como alvo qualquer coisa na doença de Alzheimer, provavelmente deveríamos ter como alvo a tau”, disse Kraemer. “É o mais estreitamente ligado ao declínio da disfunção cognitiva. Você quer se livrar do amilóide, mas o que realmente quer é a preservação da cognição. Isso requer o direcionamento da tau”.
Em artigo publicado na revista Anais da Academia Nacional de Ciências em 26 de dezembro, Kraemer, sua equipe e o principal autor Randall Eck, aluno do Programa de Pós-Graduação em Neurociência da UW, relatam a identificação de uma proteína que parece ser crucial na formação de coleções anormais de tau. Os cientistas mostraram que, bloqueando o gene necessário para a produção da proteína, é possível evitar o acúmulo de tau em um modelo animal.
A proteína é chamada de proteína POZ do tipo speckle (SPOP). O nome refere-se a como ele é encontrado em compartimentos semelhantes a manchas na célula e ao fato de conter um trecho específico de aminoácidos conhecido como domínio POZ. Esta é uma das várias proteínas que Kraemer e seus colegas associaram a tauopatias. Outra proteína, chamada SUT-2 para supressor da tauopatia-2, está sendo explorada por seu potencial terapêutico.
O papel exato que a proteína desempenha nas doenças envolvendo tau não é claro. Mas parece estar envolvido em um processo essencial pelo qual as células manipulam e eliminam proteínas defeituosas. As descobertas sugerem que, se pudessem ser desenvolvidas drogas que inibem o efeito dessa proteína, seria possível tratar a doença de Alzheimer e outras tauopatias.
Para identificar essas proteínas reguladoras chave, Kraemer e seus colegas de trabalho usam um modelo animal seu laboratório criado há duas décadas. O modelo é uma versão geneticamente modificada de um pequeno verme, normalmente encontrado no solo, chamado Caenorhabditis elegans, ou C. elegans, para abreviar. C. elegans vive apenas cerca de três semanas, por isso é ideal para estudar como as mutações genéticas afetam o crescimento, o desenvolvimento e a função de um organismo ao longo de sua vida útil.
Para criar o modelo, Kraemer e sua equipe introduziram o gene humano para a proteína tau nas lombrigas.
Em seus experimentos, os cientistas demonstraram que os vermes alterados desenvolvem muitas das anormalidades observadas nas tauopatias humanas: o acúmulo de tau insolúvel, morte progressiva de células nervosas, déficits comportamentais e redução da expectativa de vida.
Os pesquisadores então realizaram uma triagem de todos os genes do verme para ver se eliminar aleatoriamente algum deles poderia impedir essas mudanças. Essa abordagem os levou a identificar primeiro o gene para SUT-2 e, mais recentemente, SPOP.
“Quando eliminamos a proteína SPOP em nosso modelo de verme tau, vemos uma diminuição dramática no acúmulo de tau e morte progressiva de células nervosas, bem como uma melhora nos déficits comportamentais e na expectativa de vida”, disse Eck.
Kraemer, Eck e outros pesquisadores da área estão agora investigando se suas descobertas neste modelo de C. elegans podem ser traduzidas em tratamentos em humanos. O primeiro passo é ver se a supressão desses genes pode ter um efeito protetor semelhante em um modelo de camundongo da doença. Os estudos que suprimem o gene do SUT-2 são promissores e estudos sobre o SPOP estão em andamento.
“Ainda estamos nos primeiros dias de desenvolvimento de medicamentos eficazes modificadores da doença de Alzheimer”, disse Kraemer. “Um inibidor da tau pode ser suficiente para tratar tauopatias puras, mas para o Alzheimer acho que teremos que atingir tanto a tau quanto a amilóide para obter um tratamento eficaz”.
Eck, Randall J. et al, perda de função SPOP protege contra tauopatia, Anais da Academia Nacional de Ciências (2022). DOI: 10.1073/pnas.2207250120. doi.org/10.1073/pnas.2207250120
Fornecido por
Escola de Medicina da Universidade de Washington
Citação: Visando a tau, a outra proteína por trás da doença de Alzheimer (2022, 27 de dezembro) recuperada em 27 de dezembro de 2022 em https://medicalxpress.com/news/2022-12-tau-protein-alzheimer-disease.html
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem a permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Segue as Notícias da Comunidade PortalEnf e fica atualizado.(clica aqui)