Explorando o efeito de uma mutação associada ao autismo nos movimentos de proteínas

Pesquisadores da Universidade de Kumamoto descobriram que a mutação H58Y reduz a mobilidade de TOP2B, uma proteína envolvida na resolução de cepas estruturais no DNA durante a transcrição e replicação. Crédito: Kenichi Yano da Universidade de Kumamoto
Os processos de replicação e transcrição do DNA podem introduzir cepas de torção (ou torção) na estrutura do DNA. Esses problemas topológicos são aliviados por uma enzima chamada topoisomerase II (TOP2) por meio de uma série de reações.
Uma enzima importante a este respeito, TOP2 tem uma estrutura evolutivamente conservada compreendendo um domínio ATPase N-terminal, núcleo catalítico e um domínio C-terminal. Notavelmente, os humanos têm dois tipos de TOP2: TOP2A, essencial para os processos de divisão celular, e TOP2B, um importante participante na proliferação e expressão gênica dos neurônios.
Uma série de estudos anteriores revelou que missense mutações no domínio catalítico de TOP2B pode levar a consequências deletérias.
Recentemente, em pacientes com transtorno do espectro autista e atraso global do desenvolvimento, uma mutação germinativa heterozigótica (ou seja, uma mutação genética em uma célula reprodutiva que mais tarde se reflete em todas as células da prole) foi descoberta no domínio ATPase de TOP2B. Nessa mutação, a histidina é substituída por tirosina na 58ª posição e, portanto, é chamada de substituição H58Y (doravante referida como TOP2B H58Y).
Curiosamente, esta mutação não causa grandes alterações estruturais no TOP2B. Assim, os pesquisadores supuseram que causa uma mudança funcional não relacionada à atividade catalítica do TOP2B.
Para entender melhor o significado biológico da mutação H58Y, um grupo de pesquisadores liderado pelo Prof. Ken-ichi Yano, da Universidade de Kumamoto, no Japão, realizou um conjunto abrangente de experimentos. Seus resultados são publicados em Relatórios Científicos.
Explicando a motivação por trás do estudo, o Prof. Yano diz: “Avanços recentes na análise do genoma revelaram várias mutações genéticas associadas a doenças. Apesar desses avanços, no entanto, o efeito dessas mutações nas proteínas permanece desconhecido. Este estudo fornece uma exemplo de como as mutações afetam o comportamento das proteínas nas células.”
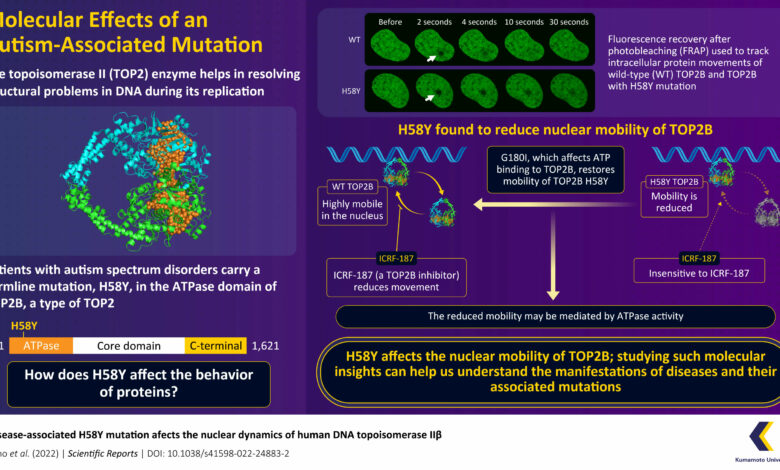
A recuperação de fluorescência após fotobranqueamento (FRAP) é um método de monitoramento de movimentos moleculares intracelulares. Usando a análise FRAP, a equipe comparou a dinâmica nuclear do tipo selvagem TOP2B (TOP2B WT) com TOP2B H58Y. A mobilidade é uma característica importante das proteínas nucleares e é crucial para a execução de várias funções biológicas. Curiosamente, TOP2B H58Y foi significativamente menos móvel em comparação com TOP2B WT.
A mobilidade reduzida de TOP2B H58Y foi ainda confirmada por sua insensibilidade a um inibidor de TOP2, ICRF-187, que reduz a mobilidade de TOP2 prendendo-o ao DNA. Embora o TOP2B H58Y não tenha reagido ao ICRF-187, sua resposta a um veneno TOP2, o etopside, que inibe a proliferação, foi semelhante ao TOP2B. Este resultado sugere que a enzima mutante reteve algum do seu potencial catalítico.
Os experimentos da equipe também revelaram o mecanismo subjacente à baixa mobilidade da proteína. Eles descobriram que o G180I, que afeta a ligação do ATP ao TOP2B, poderia restaurar a mobilidade do TOP2B H58Y. Esses resultados, portanto, mostraram que os movimentos restritos de TOP2B H58Y foram mediados pela atividade da ATPase.
Esses experimentos lançaram luz sobre um raro exemplo de como uma mutação associada a uma doença poderia alterar a dinâmica nuclear, fornecendo assim uma plataforma para entender a relevância biológica de tais mutações. Mais experimentos são necessários para fornecer informações sobre o impacto funcional da mobilidade reduzida da proteína mutante e os processos moleculares subjacentes ao autismo. Otimista sobre o significado de seus resultados, o Prof. Yano conclui que esses experimentos “podem ser uma pista importante para entender a causa do autismo”.
Mais Informações:
Keiko Morotomi-Yano et al, A mutação H58Y associada à doença afeta a dinâmica nuclear da topoisomerase IIβ do DNA humano, Relatórios Científicos (2022). DOI: 10.1038/s41598-022-24883-2
Fornecido por
Universidade de Kumamoto
Citação: Explorando o efeito de uma mutação associada ao autismo nos movimentos de proteínas (2023, 18 de janeiro) recuperado em 18 de janeiro de 2023 em https://medicalxpress.com/news/2023-01-exploring-effect-autism-associated-mutation-protein. html
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem a permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Segue as Notícias da Comunidade PortalEnf e fica atualizado.(clica aqui)