Métodos dialíticos em cuidados intensivos
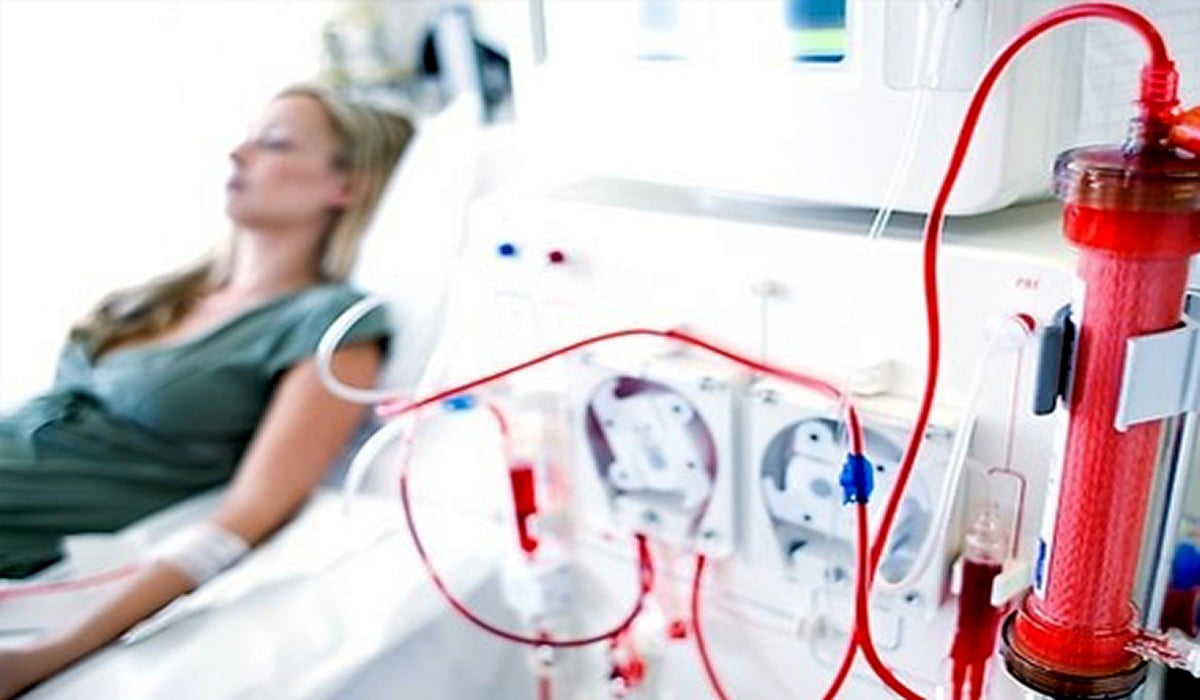
O tratamento da Insuficiência Renal Aguda (IRA) em cuidados intensivos tem mudado muito nos últimos anos. As técnicas são variadas e as opiniões divergem. Os métodos contínuos representam um grande avanço no tratamento dos doentes, sobretudo pela grande vantagem da possibilidade de uma maior estabilidade hemodinâmica e um aporte nutricional eficaz.
Considera-se, por definição, que os métodos de depuração extra-renal são, fundamentalmente, de 3 tipos:
Hemodiálise (HD) convencional, intermitente
Hemofiltração contínua
Diálise peritoneal (de que não iremos tratar)
Considerando-se a hemodiálise intermitente como um método que utiliza o transporte baseado na difusão de solutos e fluidos através de membranas de cuprofano e de celulose acetato. As novas membranas que usam polisulfonas, poliacrilonitrito ou poliamido como material básico são mais permeáveis que as antigas membranas da HD intermitente e têm maior possibilidade de tirar moléculas de maior peso molecular aumentando a clearance de moléculas de peso molecular médio.
O tratamento convencional com diálise (hemodiálise intermitente e diálise peritoneal) é cada vez menos usado nos doentes de cuidados intensivos com IRA.
Pelo contrário usam-se cada vez mais as técnicas contínuas de substituição da função renal. Estas são baseadas na hemofiltração e oferecem vantagens:
1) remoção rápida de fluidos isotónicos, sem provocar hipotensão
2) controle rápido e mantido da azotémia
3) permitem a administração de grandes quantidades de fluidos, como por exemplo na alimentação parentérica total (APT) e de produtos derivados do sangue.
A sua simplicidade levou ao grande uso em Unidades de Cuidados Intensivos (UCI) sem necessidade de recorrer a enfermeiros de hemodiálise.
O tratamento com hemofiltração leva a um grau de purificação do sangue muito útil em doentes com sepsis e com mediadores humorais em circulação, havendo quem defenda que eles são retirados da circulação sanguínea com estes métodos.
Estes factores têm levado a uma melhoria da sobrevida dos doentes críticos; facto provado em alguns estudos mas, infelizmente infirmado em outros.
1- História
As primeiras descrições de técnicas contínuas surge em 1977 (Kramer – Hemofiltração arteriovenosa Contínua – CAVH). O sangue arterial circula através de uma membrana porosa; o ultrafiltrado é produzido essencialmente livre de proteínas, com uma composição semelhante ao soro. Remove grandes quantidades de ultrafiltrado (UF) (10 l/dia), com clearance de ureia de 10-12 ml/min permitindo a remoção de edemas e a administração de drogas, derivados do sangue e nutrição parentérica, sem grandes preocupações com a sobrecarga de volume.
A técnica é simples mas exige acessos arterial e venoso.
Nos anos 80 a técnica é modificada de modo a melhorar a clearance de ureia.
Administrando fluidos pré-filtro ou juntando uma bomba ao UF consegue-se aumentar a produção de UF e melhorar a clearance da ureia para 17-18 ml/min.
Juntando um componente dialítico à clearance convectiva consegue-se aumentar a clearance da ureia – com esta nova técnica – Hemodiafiltração arteriovenosa contínua (HDFAVC), dependendo do tipo de dialisante, do fluxo do dialisante e do filtro utilizado. Bombeando um fluido de diálise em contracorrente no filtro (habitualmente a 1 l/h) consegue-se aumentar a clearance de ureia e de creatinina para 25 ml/min.
Passaram a utilizar-se cateteres de duplo lumen, puncionando apenas um vaso – Hemodiafiltração venovenosa contínua (HDFVVC). Esta técnica aparentemente complicada, é, na verdade, mais simples e com menos complicações que a hemodiálise.
2- Mecanismos Básicos
Difusão – as moléculas movem-se casualmente em todas as direcções de forma a atingirem iguais concentrações nos dois lados da membrana.
Convecção – os solutos são transportados através da membrana pelos movimentos do solvente (ultrafiltração) em resposta à pressão transmembranária. Aqui a permeabilidade da membrana (coeficiente de sieving) tem um papel muito importante.
Ultrafiltração – o transporte de água através da membrana depende da pressão transmembranária (PTM) e da permeabilidade hidráulica do coeficiente da membrana.
3- Indicações
Doentes em Insuficiência renal aguda, em Insuficiência renal crónica agudizada ou em insuficiência renal crónica internados por outra patologia.
1) Sindroma urémico – náuseas, vómitos, alterações do estado de consciência, hálito urémico, atrito pericárdico, neuropatia periférica, Tempo de Protrombina (TP) alterado, com clearance da creatinina < 5 ml/min.
Nos doentes com nefropatia diabética deve iniciar-se diálise mais precocemente, com clearance de creatinina > 15 ml/min.
Não há valores de ureia ou creatinina séricos standard para o início de diálise, mas podemos considerar que valores de ureia > 100 mg/dl e de creatinina > 4,5 mg/dl não deverão ser ultrapassados.
2) Hipercaliémia
3) Excesso de líquidos corporais, que não responderam à terapêutica médica (vasodilatadores, diuréticos, dopamina).
4) Acidose metabólica grave, com contra-indicação do uso de bicarbonato de sódio.
5) Intoxicação por drogas (hemoperfusão).
6) Hipercalcémia grave.
7) Hiperuricémia grave.
8) Hiponatrémia grave.
5. Acesso vascular
Dadas as características dos doentes, praticamente todos utilizam cateteres venosos de duplo lumen, colocado preferencialmente na veia femoral (cateteres de 18 a 20 cm), com poucas complicações, nomeadamente infecciosas e baixas taxas de recirculação.
4 . Técnicas
As técnicas contínuas podem ser divididas em arteriovenosas e venovenosas, distinguindo-as a utilização de bomba de sangue nos métodos venovenosos.
Qualquer dos métodos permite a remoção de agua , electrólitos e outros solutos de baixo peso molecular pelo princípio de convecção (CAVH e CVVH) ; adicionalmente a utilização de infusão de líquido de diálise confere o componente dialítico à técnica (CAVHD/CAVHDF e CVVHD/CVVHDF)
Vários destes métodos estão agora em uso:
1) Hemofiltração arteriovenosa contínua – CAVH
2) Hemofiltração arteriovenosa contínua – CAVH com pré-diluição
3) Hemofiltração arteriovenosa contínua – CAVH com sucção
4) Hemodiálise arteriovenosa contínua – CAVHD
5) Hemofiltração venovenosa contínua – CVVH
6) Hemodiálise venovenosa contínua – CVVHD
7) Hemodiafiltração venovenosa contínua – CVVHDF
1) Ultrafiltração contínua lenta (SLUF) – o processo contínuo de remoção de fluidos através de uma membrana semipermeável. Habitualmente executa-se com graus de ultrafiltração (UFR) menores que 8 ml/min. Não se usa líquido de substituição.
2) Hemofiltração arteriovenosa contínua (CAVH) – o processo contínuo de remoção de fluidos com redução conectiva de toxinas urémicas. Requer o uso de líquido de substituição para prevenir a perda excessiva de fluidos. Habitualmente executa-se com graus de ultrafiltração (UFR) maiores que 8 ml/min. O fluxo de sangue (QB) é expontâneo através de um shunt AV ou da cateterização de uma artéria e veia femorais.
3) Hemofiltração venovenosa contínua (CVVH) – hemofiltração contínua com a ajuda de uma bomba de sangue. Esta bomba garante adequado fluxo de sangue para manter graus de ultrafiltração (UFR) adequados. O acesso venoso é habitualmente a veia sub-clávia, jugular ou femoral usando um cateter de duplo lumen.
4) Hemodiálise arteriovenosa contínua (CAVHD) – a remoção contínua de fluidos com difusão de toxinas urémicas para um dialisador estéril. O fluxo de sangue é expontâneo através de um shunt AV ou de um cateterismo femoral de uma artéria e de uma veia. O fluxo do fluido de diálise (QD) é habitualmente mantido entre 15-35 ml/min. O fluxo de sangue e o fluxo do fluido de diálise são em contra-corrente para maximizar a difusão.
5) Hemodiálise venovenosa contínua (CVVHD) – hemodiálise contínua com a ajuda de uma bomba de sangue e utilizando acesso venoso.
6) Hemodiafiltração arteriovenosa contínua ( CAVHDF) – o mesmo que 4) CAVHD, mas com maiores UFR, em que é colocada no pós-filtro uma bomba que infunde soluto de hemofiltração, de modo a compensar as perdas excessivas de fluidos no UF.
7) Hemodiafiltração venovenosa contínua (CVVHDF) – o mesmo que 5) CVVHD, mas com maiores UFR, utilizando uma bomba para infusão de soluto de hemofiltração de modo a compensar as perdas excessivas de fluidos. Método de escolha em doentes críticos hemodinâmicamente instáveis.
Fig. 1
| Mecanismo | Convecção |
| Clearance de Ureia | Baixo |
| Ultrafiltrado | 20-25 L./dia |
Tabela 1
Na CAVH o funcionamento do sistema depende exclusivamente das pressões arteriais, resistência venosa ao fluxo sanguíneo resultante da pressão arterial, contrapressão venosa e características do filtro (tipo de superfície, área e resistência interna do filtro)
Ao montar as linhas há que ter em conta que o comprimento das mesmas deve manter-se o menor possível de forma a evitar quebras da pressão no circuito arterial ou aumento da resistência no circuito venoso.
Ter também em conta que a distância entre o filtro e o recipiente colector de ultrafiltrado deverá ser a maior possível de forma a criar uma pressão diferencial elevada.
Os doentes com IRA sujeitos a CAVH necessitam por regra de UF entre 15 e 20 L./dia. Para aumentar a eficácia da técnica utilizam-se vários métodos, que têm como objectivo final aumentar o volume de ultrafiltrado –pré-diluição e sucção.
Fig. 2
| Mecanismo | Difusão+Convecção |
| Clearance de Ureia | Elevado |
| Fluxo de Dialisante | 1.5-2 L./hora |
| Ultrafiltrado | 20-25 L./dia |
Tabela 2
Nos doentes hipercatabólicos utilizamos técnica semelhante à CAVH, mas em que se infunde um banho de diálise no circuito externo do hemofiltro utilizando o princípio da contracorrente. O fluxo de dialisante é controlado através de bomba infusora.
Com esta modificação adiciona-se o componente dialítico à técnica – CAVHD – permitindo que substâncias como a ureia e creatinina seja eliminadas por difusão, como na diálise convencional, mantendo sempre a produção de ultrafiltrado.
Com esta técnica conseguimos com um fluxo de sangue de 100ml/h e um fluxo de dialisante de 1,5 L/h, clearances de 15-20 ml/min e volumes de ultrafiltrado superiores a 15 litros.
Nos métodos venovenosos usamos apenas um acesso venoso e um cateter de duplo lumen, e ainda uma bomba de sangue para criar pressão diferencial entre a entrada e saída do sistema. A adição do componente dialítico obedece à mesma orientação da CAVHD/CAVHDF.
Este método tem a vantagem de permitir adaptar o volume de UF à situação clínica do doente. Assim, doentes em situação hemodinâmica crítica podem ser submetidos aos métodos venovenosos através do ajuste cuidadoso da velocidade da bomba de sangue.
Qual a melhor técnica a usar?
1) dependente da experiência pessoal
2) dependente da disponibilidade de bombas
3) dependente do nível do staff da UCI
4) dependente do tipo de doente necessitando de terapêutica
5) devem utilizar-se as técnicas que permitem mais UF e diálise
6) dependente igualmente do número de doentes a necessitar
A técnica preferível é a CVVHDF.
A mortalidade é menor com CVVH que com CAVH.
A morbilidade é menor com CVVHD que com CAVHD e há mais clearance de ureia.
De notar que o uso de bombas não aumenta o trabalho da enfermagem.
Estas técnicas são medidas de suporte e não têm papel directo no processo evolutivo da doença. Estatisticamente e em grande número de doentes verifica-se uma quebra de 20-25 % na mortalidade.
Em doentes de grau intermédio de severidade de doença (Apache II 24/29, com 2 a 4 orgãos atingidos) há maior sobrevida.
Nota-se igualmente mais estabilidade hemodinâmica, mais controle da azotémia e dos níveis de electrólitos e maior capacidade para administrar APT.
7. Filtro
Membranas sintéticas –
polisulfonas (PS) –
poliamido –
poliacrilonitrilo (PAN) –
polimetilmetacrilato (PMMA) –
Membranas celulósicas –
cuprofano (são capazes de estimular a activação dos monocitos com libertação de citoquinas e mediadores químicos; em doentes sépticos podem aumentar os níveis plasmáticos de vários mediadores por imunoestimulação dos macrófagos)
Os de polisulfonas e poliacrilonitrilo são os mais biocompatíveis e por isso os mais usados.
No entanto não há estudos comparativos em termos de clearances, vida do filtro e eficácia de purificação do sangue.
Há duas configurações: fibras ocas e placas paralelas(com maiores clearances)
As características a levar em conta são:
A área e o coeficiente de ultrafiltração (KUF), expresso em ml/h/mm Hg.
O filtro é escolhido em função da superfície corporal do doente e da quantidade de líquido que se pretende ultrafiltrar.
Peso em Kg < 40 ————– área em m2 – 0,7
Peso em Kg > 40 < 60 ——— área em m2 – 0,9
Peso em Kg > 60 < 90 ——— área em m2 – 1,2
Peso em Kg > 90 ————– área em m2 – 1,4
O habitual é conseguir clearance de ureia de 140 a 175 ml/min com um débito de sangue de 200 ml/min.
Doentes com anemia grave, hipotensos, hipovolémicos devem usar filtros com menor área. Nas primeiras sessões (2/3) usar filtros de menores dimensões.
Os filtros comercializados e mais frequentemente utilizados são:
| Marca | Tipo de Membrana |
| Hospal –França | Poliacrilonitrilo |
| Amicon – USA | Polisulfona |
| Gambro – Suécia | Poliamido |
| Fresenius – Alemanha | Polisulfona |
Tabela 3
5- Anticoagulação
Para prevenir a perda de eficácia da UF e a coagulação do filtro e das linhas
Heparina: em muito baixas dose (300 U/h)
em baixas doses (500 U/h)
dose convencional (10 U/Kg/h)
ou PTT >2 vezes o normal
Heparinização regional: heparina no pré-filtro e sulfato de protamina no pós-filtro – actualmente fora de uso dadas as alterações da coagulação que surgem igualmente com o sulfato de protamina.
Com os filtros de placas conseguem-se vidas do filtro > 24 horas sem heparinização.
Alternativas: 1) heparinas de baixo peso molecular
2) prostaciclina (hipotensão)
3) citrato (regional) e infusão de cálcio (alcalose metabólica)
4) inibidores das proteases
Actualmente não utilizamos (mais de 80% dos doentes) qualquer anticoagulação, fazendo infusão pré-filtro de líquido especial de hemofiltração ou soro fisiológico normal (entre 200 e 400 cc por hora) e lavagens frequentes do filtro e linhas (20 em 20 minutos), com cerca de 200 cc de soro fisiológico.
Evidentemente que a infusão pré-filtro de solutos pode levar à perda de eficácia dialítica, mas habitualmente, o que pretendemos é a estabilização hídrica, electrolítica e ácido-básica dos doentes mais que a retirada de toxinas.
6- Substituição de Fluidos
Se não é usado dialisante o líquido perdido é semelhante ao soro. Se se usa contracorrente a composição do UF em certos iões é alterado (Ca, K) e o P pode aumentar.
7. Administração de drogas e clearance de hormonas e catecolaminas
A HF afecta a extracção de certas substâncias. A extracção de cada droga depende da sua ligação às proteínas, peso molecular, carga eléctrica, quantidade de UF produzido, tipo de filtro usado e da presença ou não de componente dialítico.
Em relação à clearance de hormonas e de catecolaminas e drogas inotrópicas parece que a extracção é desprezível.
Um dos problemas mais complexos, e não completamente resolvido, na UCI é a prescrição no doente em falência múltipla de orgãos, ventilado e a precisar de terapêutica de substituição renal. Para além da polimedicação, interacções medicamentosas, alteração da excreção temos de ter em linha de conta que todas as técnicas de depuração extra-renal levam à eliminação de algumas drogas.
8. Nutrição
É aceite desde meados de 70 que os doentes renais beneficiam com um adequado aporte nutricional sob a forma de hidratos de carbono, lípidos ou aminoácidos. Uma limitação a isto era a quantidade de azoto fornecido bem como o aporte excessivo de fluidos. Com o advento da hemofiltração e a adição da difusão ou convecção (hemodiafiltração), com as altas clearances de ureia, podem-se actualmente hiperalimentar os doentes críticos com IRA sem grandes problemas.
Os AA são perdidos na UF em cerca de 10%. Não parece haver perda de lípidos. Os HC difundem do dialisado para o sangue. A transferência de HC aumenta linearmente com o aumento da concentração da dextrose do dialisado.
Há poucos elementos sobre a eliminação das vitaminas e dos oligoelementos mas parece serem eliminados em pequenas quantidades.
9. Presente e futuro
O uso de métodos dialíticos contínuos na IRA em doentes críticos parece ser um tratamento óptimo.
O acesso deve ser um cateter venoso de duplo lumen, o hemofiltro deve ser de poliacrilonitrilo de placas paralelas. Deve usar-se uma bomba para regular o fluxo de sangue, com um dialisado bombeado contracorrente.
A anticoagulação deve ser flexível.
A substituição de fluidos deve ser feita levando em linha de conta o estado hemodinâmico do doente.
A nutrição deve ser de forma a providenciar energia adequada ao doente de forma a levar a um balanço azotado neutro.
A terapêutica antibiótica deve ser feita levando em linha de conta as clearances das substâncias e com monitorização dos níveis séricos dos fármacos.
As terapêuticas alternativas de substituição da função renal estão relacionadas com a utilização de membranas mais biocompatíveis (polisulfonas, poliacrilonitrito ou poliamido) e utilizam-se de variadas formas, consoante o equipamento disponível, com duração maior ou menor consoante as necessidades dos doentes e com técnicas diferentes consoante as vantagens que queremos tirar delas.
13. COMPARAÇÃO DAS TÉCNICAS
| Acesso | ||||||||
| Bomba | ||||||||
| Dialisado | ||||||||
| Filtrado (ml/hora) | ||||||||
| Filtrado (l/dia) | ||||||||
| Substituição(l/dia) | ||||||||
| Clearance ureia (ml/min) | ||||||||
| Simplicidade | ||||||||
| Custo | ||||||||
| Dialisado (ml/min) |
Tabela 4
A introdução de técnicas mais sofisticadas como a hemofiltração de alto fluxo, que levariam a uma melhor remoção de certas substâncias nocivas (citoquinas, etc.), exigem equipamento especialmente preparado para tal, que a maior parte das UCI não possui.
De qualquer forma o que se pretende com as técnicas de substituição da função renal nos doentes críticos é uma forma simples e fácil de executar a técnica, com poucos ou nenhuns riscos para o doente e facilmente monitorizável, sem necessidade de pessoal de enfermagem especialmente treinado em executar hemodiálise.
Num Simpósio recentemente realizado em Portugal (Guimarães, Dezembro de 1997) foi mostrado, surpreendentemente que algumas UCI utilizam ainda, com alguma frequência, os métodos arteriovenosos e que é utilizada com frequência a hemodiálise convencional. Nos EUA, 70 % dos doentes são tratados com métodos intermitentes, em cuidados intensivos.
Só nas UCI equipadas com máquinas mais sofisticadas se conseguem utilizar os métodos mais modernos e mais inócuos.
Se não há diferenças notórias na mortalidade dos doentes (esta está relacionada fundamentalmente com a patologia dos doentes), a morbilidade associada à técnica utilizada é mais baixa quanto mais sofisticados são os meios utilizados.
Segundo Schwilk et all, em trabalho recentemente publicado, é demonstrado claramente que não há relação entre a mortalidade e o tipo de técnica utilizado:
| Autor | |||||
| Gibney | |||||
| Wendon | |||||
| List | |||||
| Reynolds | |||||
| Schaefer | |||||
| Storck | |||||
| Storck | |||||
| Sandroni | |||||
| Bellomo | |||||
| Alarabi | |||||
| Bellomo | |||||
| Barton | |||||
| Chertow | |||||
| Schwilk |
Tabela 5
Numa UCI como aquela em que trabalhamos, com muitos doentes sépticos e com insuficiência renal aguda, onde há necessidade de fazer técnicas dialíticas frequentemente e com pessoal pouco diferenciado neste tipo de técnicas, é utilizada frequentemente uma associação de hemodiálise com hemodiafiltração venovenosas intermitentes (intermitentes porque habitualmente cada doente faz geralmente períodos dialíticos inferiores a 24 horas), utilizando uma máquina AK100 (Gambro®).
Conseguimos com este método grande estabilidade hemodinâmica, iónica e metabólica dos doentes, que estão fortemente monitorizados.
Conseguimos ter, nestes doentes, taxas de mortalidade semelhantes aos dos outros centros e taxas de morbilidade muito baixas.
Em resumo e à laia de conclusão, devemos proceder idealmente do seguinte modo:
- Acesso – cateter venoso de duplo lumen
- Hemofiltro – em poliacrilonitrilo de placas paralelas
3) Uso de bomba para regular fluxo de sangue
4) Uso de dialisador bombeado em contracorrente
5) Anticoagulação flexível ou só soro pré-filtro e lavagens
6) Substituição de fluidos atendendo à hemodinâmica
7) Nutrição – aporte adequado de energia e azoto
8) Antibióticos – atender à clearance de drogas e monitorização
As vantagens da hemofiltração serão:
1) Remoção rápida de fluidos isotónicos, sem hipotensão
2) Controle rápido e mantido da azotémia
3) Possível a administração de grandes quantidades de fluidos (APT, derivados do sangue)
4) Mais estabilidade hemodinâmica
5) Técnica mais simples, não sendo necessário enfermeiro de HD
Em relação ao método ser contínuo ou descontínuo, a polémica é grande. Será necessário estudarmos os nossos próprios doentes e saber se, independentemente de preconceitos em relação ao método ser contínuo ou intermitente, os doentes melhoraram ou se mantiveram estáveis utilizando um ou outro método. Provavelmente o doente não terá necessidade de 24 horas consecutivas de tratamento e tolerará perfeitamente 24 ou 48 horas sem qualquer método dialítico
Bibliografia
Kramer, P (1977) Arteriovenous haemofiltration: a new simple method for treatment of over-hydrated patients resistent to diuretics. Kli. Wschr 55:1121-1122
Schaefer, J.H. (1991) Outcome prediction of acute renal failure in medical intensive care. Int. Care Med. 17: 19-24
Bellomo, R. (1991) Continuos arteriovenous haemofiltration in the critically ill: influence on major nutrient balances. Int. Care Med. 17: 399-402
Grootendorst, A.F. (1992) High volume haemofiltration improves right ventricular function in endotoxin-induced shock in pig. Int. Care Med. 18: 235-240
Vos, M.C. (1992) Clearance of imipenem-cilastatin in acute renal failure patients treated by continuos hemodiafiltration (CAVHD). Int. Care Med. 18: 282-285
Bagshaw, O.N.T (1992) Continuos arteriovenous haemofiltration and respiratory function in multiple organ systems failure (CAVH and respiratory function e MOSF). Int. Care Med. 18: 334-338
Bellomo, R (1993) Continuos venovenous haemofiltration compared with conventional dialysis in critically ill patients with acute renal failure. ASAIO J. 39:794-797
Bellomo, R. (1993) Anticoagulant regimens in acute continuos hemodiafiltration: a comparative study. Int. Care Med.19: 329-332
Ronco, C. (1993) Management of acute renal failure in the patient critically ill. Pathophysiologic foundations of critical care. Williams & Wilkins, Baltimore. 630-676
Singer, M. (1994) Heparin clearance during continous veno-venous haemofiltration. Int. Care Med. 20:212-215
Matamis, D. (1994) Influence of continuos haemofiltration-related hypotermia on haemodynamic variables and gas exchange in septic patients. Int. Care. Med. 20:431-436
Shetz, M. (1995) removal of pro-inflamatory citokines with renal replacement therapy: sense or non-sense. Int. Care Med. 21:169-176
Ronco, C. (1995) Acute renal in infancy: treatment by continuos renal replacement therapy. Int. Care Med. 21:490-499
Misset, B. (1996) A randomised cross-over comparison of the hemodynamic response to intermittent hemodialysis and continuos hemofiltration in ICU patients with acute renal failure. Int. Care Med. 22:742-746
Van der Schueren, G. (1996) Intermittent hemodialysis in critically ill patients with multiple organ dysfunction syndrome is associated with intestinal intramucosal acidosis. Int. Care Med. 22:747-751
Hoffman, J.N. (1996) Effect of haemofiltration on haemodynamics and systemic concentrations of anaphylatoxins and cytokines in human sepsis. Int. Care Med. 22:1360-1367
Van der Werf; T.S. (1997) Pharmacokinetics of piperacilin and tazobactam in critically ill patients with renal failure, treated with continuos veno-venous haemofiltration. Int. Care Med. 23:873-877
Sander, A. (1997) Haemofiltration increases IL-6 clearance in early systemic inflammatory response syndrome but does not alter IL-6 and TNF plasma response. Int. Care Med. 23:878-884
Salmon, J. (1997) Continuos venovenous haemofiltration using polyacrylonitrile filters does not activate contact system and intrinsic coagulation pathways. Int. Care Med. 23:38-43
Schwik, B. (1997) Epidemiology of acute renal failure and outcome of haemofiltration in intensive care. Int. Care Med. 23:1204-1211
Ronco, C (1997) Technical Requirements for high volume haemofiltration. www.invivo.net/hemofiltration/journal/texts/hvhf.html
Bellomo, R (1995) Acute Renal Failure in the critically ill.Springer-Verlag. 1995
Brown, Edwina Continuos Haemodialysis: Drugs and Nutrition
* Assistente Hospitalar Graduado de Medicina Interna. Sub-Especialista de Medicina Intensiva pela Ordem dos Médicos
** Assistente Hospitalar de Medicina Interna. Sub-Especialista de Medicina Intensiva pela Ordem dos Médicos
Publicado em “Insuficiência renal aguda em UCI”, Permanyer Portugal, Editor Pedro Ponce, 1999
Autores:
Eduardo Almeida*
mailto:ealmeida@uninet.edu
Pedro Matos Moreira**
Pedro Póvoa**
Fonte: Uninet.edu
Segue as Notícias da Comunidade PortalEnf e fica atualizado.(clica aqui)