FDA pressiona para remover medicamento para gravidez, empresa reage

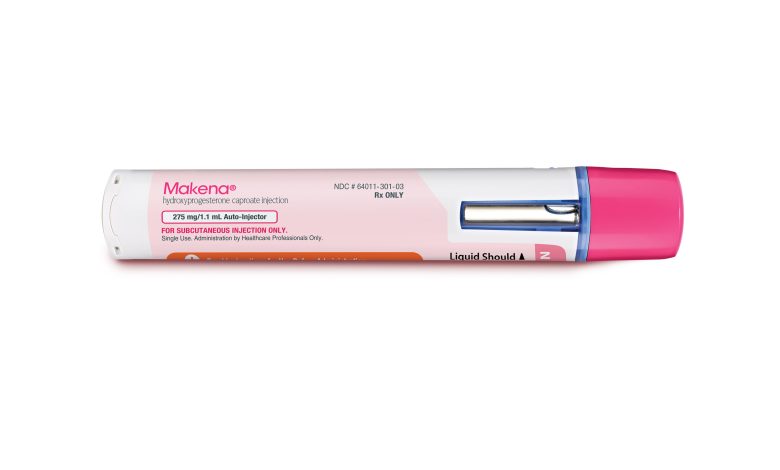
Esta imagem fornecida pela Covis Pharma mostra a embalagem do medicamento Makena da empresa. A Covis, fabricante do único medicamento dos EUA destinado a prevenir partos prematuros, fará um último esforço para manter seu medicamento no mercado em outubro de 2022, mesmo que os reguladores de saúde revisem evidências crescentes de que ele não funciona. Crédito: Covis Pharma via AP
O fabricante do único medicamento dos EUA destinado a prevenir partos prematuros está fazendo um último esforço nesta semana para manter seu medicamento no mercado, mesmo que os reguladores de saúde insistam que ele não funciona.
Uma reunião da Food and Drug Administration, aberta na segunda-feira, ocorre mais de dois anos depois que a agência declarou o medicamento ineficaz e pediu sua remoção. A farmacêutica Covis Pharma contestou a conclusão da agência, estabelecendo a altamente incomum audiência pública de três dias.
A reunião ressalta os limites da autoridade da FDA e o longo e oneroso processo para remover um medicamento nas raras ocasiões em que uma empresa não o faz voluntariamente a pedido da agência.
A audiência se assemelhará a um julgamento em um tribunal, com funcionários da FDA e cientistas da empresa apresentando argumentos a favor e contra o medicamento Makena, seguido por uma votação na quarta-feira por um painel de especialistas externos. Os líderes da FDA, em última análise, tomarão a decisão final de solicitar uma retirada.
Cerca de 10% dos nascimentos nos EUA ocorrem muito cedo – antes de 37 semanas, aumentando o risco de sérios problemas de saúde e até a morte de bebês. Para complicar o debate de Makena está o apoio do principal grupo de obstetrícia dos EUA para manter a droga de uma década disponível enquanto mais pesquisas são feitas.
“A necessidade de um tratamento eficaz para nascimento prematuro é ótimo “, diz o Colégio Americano de Obstetras e Ginecologistas. “Makena e seus genéricos associados representam o único tratamento atualmente disponível para obstetras-ginecologistas para ajudar a prevenir esta condição.”
Mas a FDA diz que os dados existentes mostram que as injeções semanais da droga não ajudam a prevenir um novo parto prematuro.
“Com base nas evidências mostradas hoje, Makena não se mostrou eficaz”, disse a chefe de medicamentos da FDA, Dra. Patrizia Cavazzoni, em seu discurso de abertura na segunda-feira. “Seu perfil de benefício e risco é desfavorável e deve ser retirado do mercado.”
A disputa provavelmente aumentará o escrutínio do chamado programa de aprovação acelerada da agência, que permite que medicamentos como o Makena sejam lançados com base em resultados iniciais promissores, enquanto estudos adicionais, geralmente maiores, são conduzidos.
“Makena está sendo usado como um exemplo das muitas críticas a este programa”, disse Rachel Sachs, especialista em legislação alimentar e de drogas da Universidade de Washington de St. Louis. “Isso pode não ser justo com outras drogas, outras doenças, outros grupos de pacientes, mas somos forçados a responder à situação que apresenta”.
Na melhor das hipóteses, o programa de aprovação acelerada é creditado por acelerar a disponibilidade de terapias inovadoras para HIV e câncer. Mas na última década, a FDA tem sido cada vez mais criticada por não acompanhar medicamentos acelerados com dados confirmatórios incompletos ou não convincentes, incluindo um grande número de medicamentos caros contra o câncer no mercado.
Nos últimos anos, a divisão de câncer da FDA começou a estimular as empresas a pararem de vender seus medicamentos para usos concedidos sob essas chamadas “aprovações pendentes”.
A FDA aprovou Makena em 2011 com base em um pequeno estudo sugerindo que reduzia as taxas de parto prematuro em mulheres com histórico de partos prematuros. Makena consiste em uma versão sintética do hormônio progesterona, que ajuda o útero a crescer e manter a gravidez. As mulheres podem iniciar as injeções após 16 semanas de gravidez.
A aprovação acelerada foi concedida com a condição de que o desenvolvedor original de Makena, Hologic, conduzisse um estudo de acompanhamento confirmando que a droga resultou em menores taxas de incapacidade e morte entre os recém-nascidos.
Mas os resultados de um estudo internacional com 1.700 mulheres divulgados em 2019 mostraram a medicamento nem reduziu os nascimentos prematuros – como se pensava originalmente – nem resultou em resultados mais saudáveis para os bebês, aumentando o risco de coágulos sanguíneos, depressão e outros efeitos colaterais nas mães.
Em documentos informativos divulgados este mês, a FDA disse que deixar Makena no mercado “incorre em falsas esperanças, riscos associados ao tratamento e outros encargos”, como gastos médicos excessivos. De acordo com um recente relatório federalos EUA gastaram US$ 700 milhões em Makena desde 2018 por meio de vários programas governamentais, como Medicaid e Veterans Affairs.
A opinião da FDA também se aplica a várias versões genéricas da injeção.
A farmacêutica Covis argumenta que Makena é eficaz e que falhas no estudo de 2019 obscureceram seu benefício. A empresa sediada em Luxemburgo aponta que mulheres negras correm maior risco de pré-termo nascimento, mas representaram apenas 7% das mulheres no estudo internacional, em comparação com 59% no estudo original dos EUA usado para aprovação. Ele quer tempo para fazer outro estudo em pacientes de maior risco, particularmente negros americanos.
Um grupo de pacientes criado com financiamento da Covis, a Preterm Birth Prevention Alliance, apresentou argumentos semelhantes em cartas ao FDA.
“Acreditamos que não há nenhuma razão sólida de saúde pública para privar” pacientes e médicos do acesso a Makena, disse a empresa em comunicado por e-mail.
© 2022 The Associated Press. Todos os direitos reservados. Este material não pode ser publicado, transmitido, reescrito ou redistribuído sem permissão.
Citação: FDA pressiona para remover medicamento para gravidez, empresa recua (2022, 17 de outubro) recuperado em 17 de outubro de 2022 em https://medicalxpress.com/news/2022-10-fda-pregnancy-drug-company.html
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa particular, nenhuma parte pode ser reproduzida sem a permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Segue as Notícias da Comunidade PortalEnf e fica atualizado.(clica aqui)